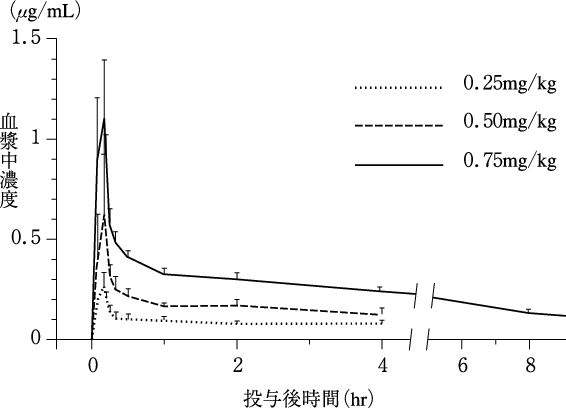
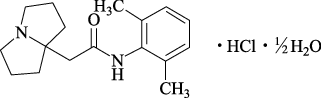
1
中島光好ほか:臨床医薬 1998;14(1):47-61
2
林 敏郎ほか:基礎と臨床 1989;23(6):2197-2229
3
小森谷和美ほか:応用薬理 2003;65(5/6):89-95
4
社内資料:ヒト血漿蛋白結合率(2000年1月18日承認、申請資料概要へ.2.3.3)
5
藤谷朝通ほか:薬物動態 1997;12(S):255
6
高畠利一ほか:薬理と治療 1989;17(7):3195-3205
7
加藤和三ほか:臨床医薬 1998;14(4):719-745〈1999年改訂〉
8
加藤和三ほか:臨床医薬 1998;14(4):747-768〈1999年改訂〉
9
加藤和三ほか:臨床医薬 1998;14(4):769-790〈1999年改訂〉
10
新 博次ほか:臨床医薬 1998;14(1):63-74
11
庄田守男ほか:臨床医薬 1998;14(1):75-88
12
日高寿範ほか:応用薬理 1989;37(4):359-372
13
Aisaka K, et al.:Arzneimittelforschung 1985;35(Ⅱ)(8):1239-1245
14
日高寿範ほか:日本薬理学雑誌 2000;115(5):295-308
15
日高寿範ほか:基礎と臨床 1992;26(13):4927-4931
16
日高寿範ほか:応用薬理 1988;36(6):439-447
17
Hattori Y, et al.:J Cardiovasc Pharmacol. 1986;8(5):998-1002
18
Inomata N, et al.:Eur J Pharmacol. 1988;145(3):313-322
19
Inomata N, et al.:Br J Pharmacol. 1991;104(4):1007-1011